- Белковые спирали и складки: Путешествие в мир вторичной структуры протеинов
- Что такое вторичная структура белка?
- Основные типы вторичной структуры
- Альфа-спираль (α-спираль)
- Бета-лист (β-лист)
- Бета-повороты (β-повороты)
- Неупорядоченные структуры (петли и витки)
- Факторы, влияющие на формирование вторичной структуры
- Методы исследования вторичной структуры белков
- Значение вторичной структуры для функции белка
- Примеры белков с различными типами вторичной структуры
Белковые спирали и складки: Путешествие в мир вторичной структуры протеинов
Белки – это строительные блоки жизни, выполняющие бесчисленное количество функций в наших организмах. От катализа биохимических реакций до формирования структурных компонентов клеток, их роль неоценима. И чтобы понять, как эти молекулярные машины работают, нам необходимо заглянуть внутрь их структуры. Мы, как исследователи и энтузиасты, отправляемся в увлекательное путешествие по миру вторичной структуры белков – ключевого уровня организации, определяющего их форму и, следовательно, их функции.
В этой статье мы углубимся в захватывающие аспекты вторичной структуры белков, рассмотрим основные типы, факторы, влияющие на их формирование, и методы исследования. Приготовьтесь погрузиться в мир аминокислотных последовательностей, водородных связей и трехмерных конфигураций, которые делают белки такими удивительными и важными.
Что такое вторичная структура белка?
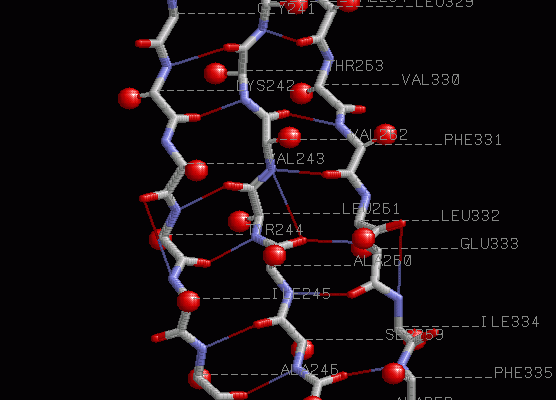
Когда мы говорим о вторичной структуре белка, мы имеем в виду локальную трехмерную форму, которую принимает полипептидная цепь. Это не просто хаотичный клубок аминокислот, а организованная структура, стабилизированная водородными связями между атомами пептидной связи. Представьте себе, что вы складываете лист бумаги – это похоже на то, как формируется вторичная структура белка. Вместо случайных изгибов и складок, возникают определенные, повторяющиеся паттерны.
Вторичная структура белка возникает из-за взаимодействий между аминокислотами, расположенными относительно близко друг к другу в полипептидной цепи. Эти взаимодействия приводят к формированию определенных трехмерных структур, которые играют важную роль в определении общей формы и функции белка.
Основные типы вторичной структуры
Существует несколько основных типов вторичной структуры, каждый из которых имеет свои уникальные характеристики:
Альфа-спираль (α-спираль)
Альфа-спираль – это, пожалуй, самая известная и распространенная вторичная структура. Она представляет собой плотно упакованную спираль, в которой аминокислотные остатки располагаются вдоль оси спирали. Водородные связи образуются между атомом кислорода карбонильной группы одной аминокислоты и атомом водорода аминогруппы аминокислоты, расположенной на четыре остатка дальше по цепи. Это создает устойчивую и жесткую структуру, напоминающую винтовую лестницу.
Представьте себе телефонный шнур, свернутый в спираль. Каждый виток спирали поддерживается водородными связями, делая структуру довольно прочной. Альфа-спирали часто встречаются в трансмембранных белках, где гидрофобные аминокислоты располагаются снаружи спирали, взаимодействуя с липидным бислоем мембраны.
Бета-лист (β-лист)
Бета-листы – это еще один важный тип вторичной структуры. Они образуются, когда две или более полипептидных цепи, называемые бета-тяжами, располагаются бок о бок и соединяются водородными связями между атомами пептидных связей. Бета-листы могут быть параллельными (бета-тяги ориентированы в одном направлении) или антипараллельными (бета-тяги ориентированы в противоположных направлениях). Антипараллельные бета-листы обычно более стабильны, чем параллельные.
Бета-листы напоминают плиссированную ткань. Водородные связи удерживают листы вместе, создавая плоскую, но гибкую структуру. Бета-листы часто встречаются в белках, выполняющих структурные функции, таких как фиброин шелка.
Бета-повороты (β-повороты)
Бета-повороты – это короткие петли, которые соединяют альфа-спирали и бета-тяги. Они позволяют полипептидной цепи менять направление и формировать компактную трехмерную структуру. Бета-повороты обычно состоят из четырех аминокислотных остатков и стабилизируются водородными связями.
Представьте себе углы на салфетке, сложенной в несколько раз. Бета-повороты – это своеобразные "углы" в белковой структуре, позволяющие ей изгибаться и складываться в более сложные формы.
Неупорядоченные структуры (петли и витки)
Не все участки полипептидной цепи формируют упорядоченные вторичные структуры. Некоторые участки, называемые петлями или витками, могут быть неупорядоченными и гибкими. Эти участки часто находятся на поверхности белка и участвуют во взаимодействии с другими молекулами.
Представьте себе нить, свисающую с клубка. Эти неупорядоченные участки могут быть очень важны для функции белка, позволяя ему связываться с другими молекулами или изменять свою форму в ответ на внешние стимулы.
Факторы, влияющие на формирование вторичной структуры
Формирование вторичной структуры белка зависит от нескольких факторов, включая:
- Аминокислотная последовательность: Разные аминокислоты имеют разную склонность к формированию определенных вторичных структур. Например, аланин и лейцин часто встречаются в альфа-спиралях, а пролин – в бета-поворотах.
- Водородные связи: Водородные связи между атомами пептидной связи являются основным стабилизирующим фактором вторичной структуры.
- Гидрофобные взаимодействия: Гидрофобные аминокислоты стремятся избегать контакта с водой и часто располагаются внутри белка, что также влияет на его вторичную структуру.
- Взаимодействие с растворителем: Окружающая среда также может влиять на вторичную структуру белка. Например, наличие солей или органических растворителей может изменить стабильность определенных вторичных структур.
"Структура определяет функцию." – Кристиан Анфинсен, лауреат Нобелевской премии по химии.
Методы исследования вторичной структуры белков
Существует несколько методов, которые мы используем для изучения вторичной структуры белков:
- Круговой дихроизм (КД): КД – это спектроскопический метод, который измеряет разницу в поглощении левого и правого циркулярно поляризованного света хиральными молекулами, такими как белки. КД-спектры могут быть использованы для оценки содержания различных вторичных структур в белке.
- Инфракрасная спектроскопия (ИК): ИК-спектроскопия основана на поглощении инфракрасного излучения молекулами. Анализ ИК-спектров позволяет определить наличие и количество различных функциональных групп в белке, а также оценить его вторичную структуру.
- Рентгеновская кристаллография: Рентгеновская кристаллография – это метод, который позволяет определить трехмерную структуру белка с высоким разрешением. Для этого белок необходимо кристаллизовать, а затем облучить рентгеновскими лучами. Анализ дифракционной картины позволяет построить трехмерную модель белка.
- Ядерный магнитный резонанс (ЯМР): ЯМР – это метод, который основан на взаимодействии ядер атомов с магнитным полем. ЯМР-спектроскопия может быть использована для изучения структуры и динамики белков в растворе.
Значение вторичной структуры для функции белка
Вторичная структура белка играет ключевую роль в определении его функции. Она влияет на:
- Общую форму белка: Вторичная структура формирует основу для дальнейшей организации белка в третичную и четвертичную структуры.
- Стабильность белка: Определенные вторичные структуры, такие как альфа-спирали и бета-листы, могут повышать стабильность белка и защищать его от деградации.
- Взаимодействие с другими молекулами: Вторичная структура может определять сайты связывания белка с другими молекулами, такими как лекарства, ферменты и другие белки.
- Каталитическую активность ферментов: Вторичная структура фермента может определять форму активного сайта и, следовательно, его каталитическую активность.
Нарушение вторичной структуры белка может привести к потере его функции и развитию различных заболеваний. Например, при болезни Альцгеймера белок амилоид-бета агрегирует в бета-листы, которые образуют амилоидные бляшки в мозге, что приводит к нейродегенерации.
Примеры белков с различными типами вторичной структуры
Чтобы лучше понять, как вторичная структура влияет на функцию белка, рассмотрим несколько примеров:
- Гемоглобин: Гемоглобин – это белок, который переносит кислород в крови. Он состоит из четырех субъединиц, каждая из которых содержит альфа-спирали. Эти спирали образуют карман, в котором связывается гем – молекула, содержащая атом железа, который связывает кислород.
- Фиброин шелка: Фиброин шелка – это белок, который образует шелковые волокна. Он состоит в основном из бета-листов, которые придают шелку прочность и гибкость.
- Коллаген: Коллаген – это белок, который является основным компонентом соединительной ткани, такой как кожа, кости и сухожилия. Он состоит из трех полипептидных цепей, свернутых в тройную спираль.
- Антитела (иммуноглобулины): Антитела содержат бета-листы, образующие антиген-связывающие участки, которые позволяют им специфически распознавать и связывать антигены.
Исследование вторичной структуры белков – это увлекательное и важное направление в биохимии и молекулярной биологии. Понимание того, как белки складываются и формируют определенные трехмерные структуры, позволяет нам лучше понимать их функции и разрабатывать новые лекарства и методы лечения заболеваний. Мы надеемся, что это путешествие в мир белковых спиралей и складок было для вас интересным и познавательным.
Мы продолжим исследовать этот удивительный мир и делиться с вами новыми открытиями.
Подробнее
| Альфа спираль структура | Бета лист строение | Водородные связи в белках | Круговой дихроизм белки | Рентгеноструктурный анализ белка |
|---|---|---|---|---|
| Аминокислотная последовательность и структура | Стабильность белка | Третичная структура белка | Функция белка и структура | Денатурация белка |