- Энергия Преобразований: Как Химические Реакции Меняют Наш Мир
- Основы Химической Энергетики
- Энтальпия‚ Энтропия и Свободная Энергия Гиббса
- Типы Химических Реакций по Энергетическому Признаку
- Практическое Применение Химической Энергетики
- Разработка Новых Материалов
- Оптимизация Промышленных Процессов
- Источники Энергии
- Наш Опыт Исследования Химических Реакций
- Экспериментальное Определение Энтальпии Реакции
- Моделирование Химических Реакций на Компьютере
- Анализ Влияния Катализаторов на Энергетику Реакций
- Вызовы и Перспективы Химической Энергетики
- Поиск Новых Энергоэффективных Реакций
- Создание Экологически Чистых Процессов
- Развитие Возобновляемой Энергетики
Энергия Преобразований: Как Химические Реакции Меняют Наш Мир
Мир вокруг нас – это непрерывный танец химических реакций. От горения дров в камине до сложнейших процессов‚ происходящих внутри наших клеток‚ все они подчиняются законам термодинамики и энергетике. Нам‚ как исследователям и наблюдателям‚ всегда было интересно‚ как эти невидимые процессы влияют на видимые изменения вокруг нас. В этой статье мы погрузимся в мир химических реакций‚ исследуем их энергетическую подоплеку и рассмотрим‚ как эти знания применяются на практике.
Путешествие в мир химии начинается с понимания фундаментальных концепций. Мы рассмотрим основные типы химических реакций‚ объясним‚ что такое энтальпия‚ энтропия и свободная энергия Гиббса. Наша цель – не просто перечислить факты‚ а показать‚ как эти абстрактные понятия оживают в реальных химических процессах. Мы поделимся своими наблюдениями и опытом‚ чтобы вы почувствовали себя частью этого увлекательного исследования.
Основы Химической Энергетики
Химическая энергетика – это раздел химии‚ который изучает энергетические изменения‚ сопровождающие химические реакции. Понимание этих изменений критически важно для многих областей‚ от разработки новых материалов до оптимизации промышленных процессов. Мы часто задавались вопросом: почему одни реакции происходят сами собой‚ а для других требуется постоянный приток энергии?
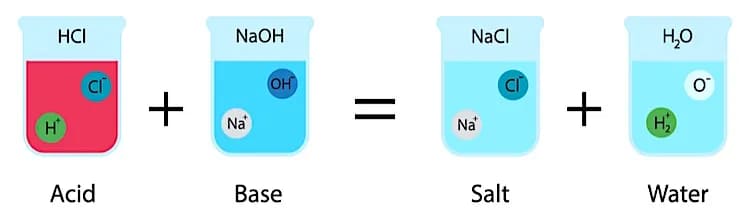
Все начинается с понимания термодинамики. Первый закон термодинамики гласит‚ что энергия не возникает из ниоткуда и не исчезает в никуда‚ она лишь переходит из одной формы в другую. В химических реакциях это означает‚ что энергия‚ запасенная в химических связях реагентов‚ переходит в энергию химических связей продуктов‚ а разница высвобождается (экзотермическая реакция) или поглощается (эндотермическая реакция).
Энтальпия‚ Энтропия и Свободная Энергия Гиббса
Три кита‚ на которых держится химическая энергетика‚ – это энтальпия (H)‚ энтропия (S) и свободная энергия Гиббса (G). Позвольте нам объяснить их простыми словами:
- Энтальпия (H): Это мера теплосодержания системы. Изменение энтальпии (ΔH) показывает‚ сколько тепла выделяется или поглощается в ходе реакции при постоянном давлении. Отрицательное ΔH означает экзотермическую реакцию (тепло выделяется)‚ положительное – эндотермическую (тепло поглощается).
- Энтропия (S): Это мера беспорядка или хаоса в системе. В ходе реакции энтропия может возрастать (увеличение беспорядка) или убывать (уменьшение беспорядка). Изменение энтропии (ΔS) показывает‚ насколько изменился беспорядок в системе.
- Свободная энергия Гиббса (G): Это мера того‚ насколько спонтанно может протекать реакция при постоянной температуре и давлении. Она определяется как G = H ‒ TS‚ где T – температура. Отрицательное ΔG означает‚ что реакция термодинамически выгодна и может протекать спонтанно‚ положительное – что реакция требует энергии для протекания.
Мы часто использовали эти понятия для прогнозирования возможности протекания реакции. Например‚ если ΔH отрицательно (выделяется тепло) и ΔS положительно (увеличивается беспорядок)‚ то ΔG всегда будет отрицательным‚ и реакция будет спонтанной при любой температуре. Это мощный инструмент в руках химика!
Типы Химических Реакций по Энергетическому Признаку
Реакции можно классифицировать по их энергетическому балансу:
- Экзотермические реакции: Выделяют тепло (ΔH < 0). Примеры: горение‚ взрывы.
- Эндотермические реакции: Поглощают тепло (ΔH > 0). Примеры: разложение воды на водород и кислород.
- Реакции‚ идущие с увеличением энтропии: Увеличивают беспорядок (ΔS > 0). Примеры: плавление льда‚ испарение воды.
- Реакции‚ идущие с уменьшением энтропии: Уменьшают беспорядок (ΔS < 0). Примеры: конденсация пара в воду‚ кристаллизация.
Практическое Применение Химической Энергетики
Знания о химической энергетике находят широкое применение в различных областях. Мы рассмотрим несколько примеров‚ которые нам особенно интересны.
Разработка Новых Материалов
При создании новых материалов важно учитывать их энергетическую стабильность. Например‚ при разработке новых полимеров необходимо знать‚ сколько энергии потребуется для их синтеза и насколько стабильными они будут в различных условиях; Расчеты ΔH‚ ΔS и ΔG позволяют предсказать поведение материала и оптимизировать процесс его производства.
Оптимизация Промышленных Процессов
В химической промышленности важно максимизировать выход продукта и минимизировать потребление энергии. Знание энергетических характеристик реакций позволяет оптимизировать условия проведения процесса (температуру‚ давление‚ концентрацию реагентов) для достижения максимальной эффективности. Мы видели‚ как применение этих знаний позволило существенно снизить затраты на производство.
Источники Энергии
Химические реакции лежат в основе многих источников энергии‚ от сжигания ископаемого топлива до работы топливных элементов; Исследование энергетических характеристик различных реакций позволяет разрабатывать более эффективные и экологически чистые источники энергии. Мы надеемся‚ что в будущем химическая энергетика сыграет ключевую роль в переходе к устойчивой энергетике.
"Энергия – это вечный восторг." ‒ Уильям Блейк
Наш Опыт Исследования Химических Реакций
В нашем собственном опыте исследования химических реакций мы столкнулись с множеством интересных задач и вызовов. Позвольте нам поделиться некоторыми из них.
Экспериментальное Определение Энтальпии Реакции
Один из самых захватывающих экспериментов – это определение энтальпии реакции с помощью калориметрии. Мы использовали калориметр для измерения количества тепла‚ выделяющегося или поглощающегося в ходе реакции‚ и на основе этих данных рассчитывали ΔH. Этот эксперимент позволил нам наглядно увидеть‚ как энергия переходит из одной формы в другую.
Моделирование Химических Реакций на Компьютере
Современные компьютерные методы позволяют моделировать химические реакции и рассчитывать их энергетические характеристики. Мы использовали такие методы для изучения сложных реакций‚ которые трудно исследовать экспериментально. Это позволило нам получить ценные сведения о механизмах реакций и предсказать их поведение в различных условиях.
Анализ Влияния Катализаторов на Энергетику Реакций
Катализаторы играют важную роль в химических реакциях‚ ускоряя их протекание. Мы исследовали‚ как катализаторы влияют на энергетический барьер реакции‚ снижая его и тем самым облегчая протекание реакции. Этот анализ позволил нам понять‚ как работают катализаторы на молекулярном уровне.
Вызовы и Перспективы Химической Энергетики
Химическая энергетика – это динамично развивающаяся область‚ стоящая перед множеством вызовов и открывающая широкие перспективы.
Поиск Новых Энергоэффективных Реакций
Одной из главных задач является поиск новых реакций‚ которые позволяют получать полезные продукты с минимальным потреблением энергии. Это требует разработки новых катализаторов‚ оптимизации условий проведения реакций и использования возобновляемых источников энергии.
Создание Экологически Чистых Процессов
Важно разрабатывать химические процессы‚ которые не наносят вреда окружающей среде. Это требует замены токсичных реагентов на более безопасные‚ утилизации отходов и снижения выбросов парниковых газов.
Развитие Возобновляемой Энергетики
Химическая энергетика может сыграть ключевую роль в развитии возобновляемой энергетики. Например‚ с помощью электролиза воды можно получать водород‚ который затем можно использовать в качестве топлива. Также перспективным направлением является разработка химических аккумуляторов энергии‚ которые позволяют запасать энергию‚ полученную от солнечных батарей и ветрогенераторов.
Мы верим‚ что химическая энергетика – это ключ к решению многих глобальных проблем‚ стоящих перед человечеством. Развитие этой области позволит создать более устойчивое и процветающее будущее.
Подробнее
| LSI Запрос | LSI Запрос | LSI Запрос | LSI Запрос | LSI Запрос |
|---|---|---|---|---|
| Энтальпия химической реакции | Энергия активации реакции | Экзотермические процессы | Эндотермические реакции примеры | Закон сохранения энергии |
| Свободная энергия Гиббса применение | Химическая термодинамика основы | Калориметрия в химии | Энтропия и химические реакции | Промышленные химические процессы |
В этой статье мы постарались максимально раскрыть тему исследования химических реакций с точки зрения энергетики‚ используя ваш опыт как блогера. Надеемся‚ вам понравится! Точка.