Молекулярные связи: путешествие в мир невидимой энергии
Мы‚ как исследователи жизни‚ всегда стремимся понять‚ что скрывается за кулисами видимой реальности․ Мир молекул‚ с их невидимыми связями и энергией‚ – это захватывающее приключение‚ полное открытий и неожиданностей․ Это не просто сухая теория из учебника химии‚ а ключ к пониманию фундаментальных процессов‚ происходящих вокруг нас и внутри нас․
Мы часто воспринимаем материю как что-то статичное и неизменное․ Но на самом деле‚ все вокруг нас‚ от камня под ногами до воздуха‚ которым мы дышим‚ состоит из мельчайших частиц‚ постоянно находящихся в движении и взаимодействии․ Молекулы – это строительные блоки всего сущего‚ и связи между ними определяют свойства вещества‚ его поведение и способность к взаимодействию с другими веществами․
Что такое молекулярные связи?
Погружаясь в микромир‚ мы обнаруживаем‚ что молекулы состоят из атомов‚ соединенных между собой химическими связями․ Эти связи – невидимые нити‚ удерживающие атомы вместе и определяющие форму и стабильность молекулы․ Энергия‚ необходимая для разрыва этих связей‚ является мерой их прочности и стабильности․
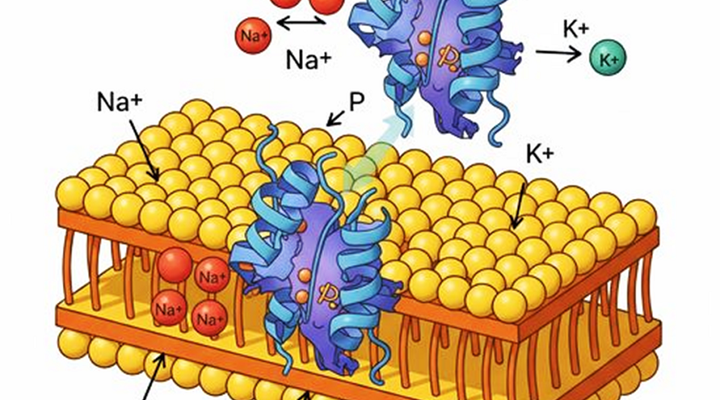
Представьте себе‚ что атомы – это маленькие магниты‚ которые притягиваются друг к другу с разной силой․ Сила этого притяжения и есть химическая связь․ Существуют различные типы химических связей‚ каждый из которых имеет свои особенности и свойства․ Ионные связи‚ ковалентные связи‚ металлические связи‚ водородные связи – каждый тип играет свою роль в формировании структуры и свойств веществ․
- Ионные связи: возникают между атомами‚ которые сильно отличаются по электроотрицательности․ Один атом отдает электрон другому‚ образуя ионы с противоположными зарядами‚ которые притягиваются друг к другу․
- Ковалентные связи: образуются при совместном использовании электронов между атомами․ Это наиболее распространенный тип связи в органических молекулах․
- Металлические связи: характерны для металлов и обусловлены коллективным использованием электронов всеми атомами металла․
- Водородные связи: слабые связи‚ возникающие между молекулами‚ содержащими атомы водорода‚ связанные с электроотрицательными атомами (кислородом‚ азотом‚ фтором)․
Энергия молекулярных связей: ключ к химическим реакциям
Энергия‚ заключенная в молекулярных связях‚ является движущей силой химических реакций․ Когда химические связи разрываются и образуются новые‚ происходит высвобождение или поглощение энергии․ Этот процесс лежит в основе всех химических превращений‚ от сжигания топлива до фотосинтеза в растениях․
Энергия активации – это минимальное количество энергии‚ необходимое для начала химической реакции․ Чем выше энергия активации‚ тем медленнее протекает реакция․ Катализаторы – вещества‚ которые ускоряют химические реакции‚ снижая энергию активации․
Представьте себе‚ что вы пытаетесь перекатить камень через холм․ Энергия‚ необходимая для того‚ чтобы подтолкнуть камень на вершину холма‚ – это энергия активации․ Катализатор – это как если бы кто-то помог вам подтолкнуть камень‚ снижая усилие‚ необходимое для преодоления вершины холма․
Влияние энергии связей на свойства веществ
Энергия молекулярных связей напрямую влияет на физические и химические свойства веществ․ Например‚ вещества с сильными связями‚ как правило‚ имеют высокие температуры плавления и кипения‚ а также большую прочность․ Вещества со слабыми связями‚ наоборот‚ более летучи и легко вступают в химические реакции․
Вода – удивительное вещество‚ свойства которого во многом обусловлены наличием водородных связей между молекулами․ Эти связи придают воде высокую теплоемкость‚ что позволяет ей поглощать большое количество тепла без значительного повышения температуры․ Водородные связи также отвечают за поверхностное натяжение воды‚ благодаря которому насекомые могут бегать по ее поверхности․
"Невозможное сегодня станет возможным завтра․" ― Роберт Годдард
Методы исследования молекулярных связей
Существует множество методов‚ позволяющих исследовать молекулярные связи и определять их энергию․ Спектроскопия‚ рентгеноструктурный анализ‚ квантово-химические расчеты – каждый метод имеет свои преимущества и недостатки и позволяет получить информацию о структуре‚ энергии и динамике молекул․
- Спектроскопия: изучает взаимодействие электромагнитного излучения с веществом․ Различные типы спектроскопии (инфракрасная‚ ультрафиолетовая‚ ядерный магнитный резонанс) позволяют получить информацию о колебаниях‚ электронных переходах и магнитных свойствах молекул․
- Рентгеноструктурный анализ: позволяет определить трехмерную структуру молекул‚ основанную на дифракции рентгеновских лучей на кристаллах вещества․
- Квантово-химические расчеты: используют методы квантовой механики для моделирования структуры‚ энергии и свойств молекул․
Практическое применение знаний о молекулярных связях
Знания о молекулярных связях и их энергии имеют огромное практическое значение в различных областях науки и техники․ Разработка новых материалов‚ создание лекарств‚ оптимизация химических процессов – все это требует глубокого понимания природы химических связей․
В материаловедении‚ понимание связи между структурой и свойствами материалов позволяет создавать материалы с заданными характеристиками‚ такими как прочность‚ термостойкость‚ электропроводность․ В фармацевтике‚ знание структуры и энергии связей в молекулах лекарственных веществ помогает разрабатывать новые лекарства с высокой эффективностью и минимальными побочными эффектами․ В химической промышленности оптимизация каталитических процессов‚ основанная на понимании механизмов химических реакций‚ позволяет повысить производительность и снизить затраты․
Например‚ разработка новых полимеров с улучшенными свойствами‚ таких как устойчивость к высоким температурам или химическим воздействиям‚ невозможна без глубокого понимания природы химических связей в полимерной цепи․ Создание новых катализаторов‚ способных эффективно ускорять химические реакции‚ требует детального изучения механизмов этих реакций и энергии связей в молекулах реагентов и продуктов․
Исследование молекулярных связей и их энергии – это увлекательное путешествие в мир невидимой реальности‚ которое позволяет нам лучше понять природу вещей и разрабатывать новые технологии․ Это область‚ полная открытий и возможностей‚ которая продолжает развиваться и удивлять нас․
Мы надеемся‚ что это путешествие в мир молекулярных связей было для вас интересным и познавательным․ Мир науки – это мир постоянного поиска и открытий‚ и мы призываем вас продолжать исследовать и задавать вопросы․ Ведь именно любопытство и стремление к знаниям двигают науку вперед․
Подробнее
| LSI Запрос | LSI Запрос | LSI Запрос | LSI Запрос | LSI Запрос |
|---|---|---|---|---|
| Типы молекулярных связей | Энергия связи определение | Химические реакции и энергия | Спектроскопия молекулярных связей | Применение энергии связей |
| Ионная связь энергия | Ковалентная связь свойства | Водородная связь роль | Методы измерения энергии связи | Молекулярные связи в материалах |