- Разгадывая Тайны: Четвертичная Структура Белка – От Загадки к Пониманию
- Что такое белок и зачем ему структура?
- Уровни организации белковой структуры
- Почему нам важны все эти уровни?
- Четвертичная структура: Когда один хорошо, а вместе – лучше
- Взаимодействия, формирующие четвертичную структуру
- Преимущества четвертичной структуры
- Методы исследования четвертичной структуры
- Роль четвертичной структуры в заболеваниях
- Будущее исследований четвертичной структуры
Разгадывая Тайны: Четвертичная Структура Белка – От Загадки к Пониманию
Приветствую, уважаемые читатели! Сегодня мы с вами погрузимся в удивительный мир биохимии, а точнее – в захватывающую область исследования структуры белков. Мы, как энтузиасты науки, всегда стремимся понять, как устроены мельчайшие кирпичики жизни, и белки, безусловно, одни из самых важных. Они выполняют огромное количество функций в нашем организме, от катализа реакций до транспортировки кислорода. Но как же они устроены? И почему их структура так важна?
В этой статье мы с вами подробно разберем четвертичную структуру белков – один из самых сложных и интересных уровней организации этих удивительных молекул. Мы постараемся объяснить все простым и понятным языком, чтобы даже те, кто далек от биохимии, смогли понять, как все работает. Приготовьтесь к увлекательному путешествию в мир молекулярной биологии!
Что такое белок и зачем ему структура?
Прежде чем мы перейдем к четвертичной структуре, давайте немного освежим в памяти, что такое белок в принципе. Белки – это большие органические молекулы, состоящие из аминокислот, соединенных между собой пептидными связями. Представьте себе бусы, где каждая бусинка – это аминокислота, а нить, соединяющая их – это пептидная связь.
Но почему белкам так важна структура? Дело в том, что функция белка напрямую зависит от его формы. Точно так же, как ключ должен иметь определенную форму, чтобы открыть замок, белок должен иметь определенную трехмерную структуру, чтобы выполнять свою задачу в организме. Эта структура формируется благодаря различным взаимодействиям между аминокислотами, а также с окружающей средой.
Уровни организации белковой структуры
Белковая структура организована в четыре уровня: первичный, вторичный, третичный и четвертичный. Давайте кратко рассмотрим каждый из них:
- Первичная структура: Это последовательность аминокислот в полипептидной цепи. Это, по сути, тот самый порядок бусинок в наших бусах.
- Вторичная структура: Это локальные, повторяющиеся структуры, образующиеся за счет водородных связей между атомами основной цепи полипептида. Примеры – альфа-спирали и бета-листы.
- Третичная структура: Это трехмерная форма всей полипептидной цепи, включающая в себя все вторичные структуры и их взаимное расположение. Она формируется за счет различных взаимодействий между аминокислотными радикалами (R-группами).
- Четвертичная структура: Это пространственная организация нескольких полипептидных цепей (субъединиц) в составе одного белкового комплекса. Именно ее мы и будем подробно изучать сегодня.
Почему нам важны все эти уровни?
Каждый уровень организации структуры белка играет свою роль в определении его конечной формы и, следовательно, его функции. Представьте себе, что вы строите дом; Первичная структура – это как выбор кирпичей, вторичная – как формирование стен, третичная – как построение отдельных комнат, а четвертичная – как объединение нескольких комнат в один дом. Если хоть один из этих этапов будет выполнен неправильно, дом может рухнуть, а белок – потерять свою функциональность.
Четвертичная структура: Когда один хорошо, а вместе – лучше
Итак, мы подошли к самому интересному – четвертичной структуре. Как мы уже говорили, она возникает, когда два или более полипептидных цепей (субъединиц) объединяются, чтобы сформировать функциональный белковый комплекс. Эти субъединицы могут быть одинаковыми или разными, и их взаимодействие определяет конечную структуру и функцию белка.
Примерами белков с четвертичной структурой являются:
- Гемоглобин: Белок, переносящий кислород в крови, состоит из четырех субъединиц – двух альфа-глобинов и двух бета-глобинов.
- Антитела (иммуноглобулины): Белки, участвующие в иммунном ответе, обычно состоят из двух тяжелых и двух легких цепей.
- ДНК-полимераза: Фермент, участвующий в репликации ДНК, часто состоит из нескольких субъединиц, каждая из которых выполняет определенную функцию.
Взаимодействия, формирующие четвертичную структуру
Как же субъединицы удерживаются вместе в четвертичной структуре? За счет тех же самых нековалентных взаимодействий, которые стабилизируют третичную структуру, а именно:
- Водородные связи: Слабые, но многочисленные связи между атомами водорода и электроотрицательными атомами (кислород, азот).
- Ионные связи: Взаимодействия между положительно и отрицательно заряженными аминокислотными радикалами.
- Гидрофобные взаимодействия: Стремление неполярных аминокислот избегать контакта с водой, что приводит к их "слипанию" в центре белка.
- Ван-дер-ваальсовы силы: Слабые, кратковременные взаимодействия между атомами, возникающие из-за флуктуаций электронной плотности.
- Дисульфидные связи: Ковалентные связи между остатками цистеина.
Важно отметить, что вклад каждого типа взаимодействия в стабилизацию четвертичной структуры зависит от конкретного белка и его окружения.
Преимущества четвертичной структуры
Зачем вообще белкам нужна четвертичная структура? В чем ее преимущества по сравнению с белками, состоящими из одной полипептидной цепи?
- Регуляция активности: Взаимодействие между субъединицами может регулировать активность белка. Например, связывание молекулы с одной субъединицей может влиять на активность других субъединиц (аллостерическая регуляция).
- Кооперативность: В некоторых случаях связывание лиганда (молекулы, связывающейся с белком) с одной субъединицей облегчает связывание лиганда с другими субъединицами. Примером является гемоглобин, где связывание кислорода с одной субъединицей увеличивает сродство к кислороду других субъединиц.
- Структурная стабильность: Объединение нескольких субъединиц может повысить стабильность белкового комплекса и защитить его от деградации.
- Формирование активного центра: В некоторых случаях активный центр фермента (место, где происходит каталитическая реакция) формируется за счет аминокислотных остатков, расположенных на разных субъединицах.
"Структура определяет функцию." – Кристиан Анфинсен, лауреат Нобелевской премии по химии за работы по рибонуклеазе.
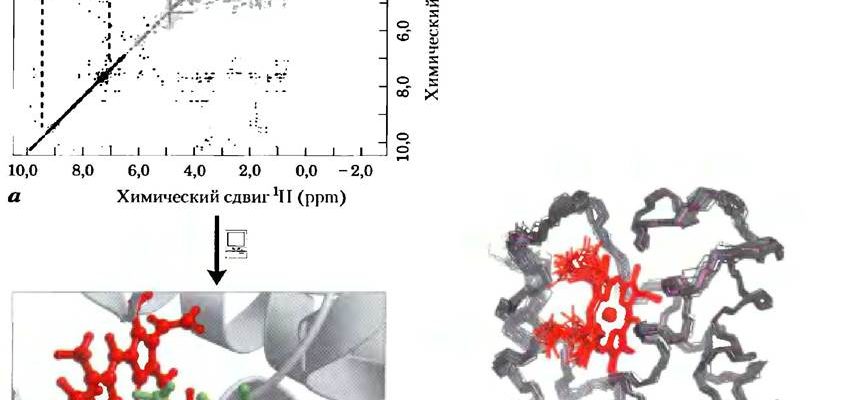
Методы исследования четвертичной структуры
Как ученые изучают четвертичную структуру белков? Существует несколько методов, позволяющих получить информацию о количестве субъединиц, их расположении и взаимодействиях:
- Рентгеновская кристаллография: Это один из самых мощных методов, позволяющий получить трехмерную структуру белка с атомным разрешением. Для этого белок кристаллизуют, а затем облучают рентгеновскими лучами. Анализ дифракционной картины позволяет определить положение каждого атома в белке.
- Криоэлектронная микроскопия (крио-ЭМ): Этот метод позволяет изучать структуру белков в замороженном, гидратированном состоянии, что приближает условия к физиологическим. Крио-ЭМ особенно полезна для изучения больших белковых комплексов, которые трудно кристаллизовать.
- Аналитическая ультрацентрифугация: Этот метод позволяет определить молекулярную массу белка и его субъединичный состав.
- Масс-спектрометрия: Этот метод позволяет идентифицировать белки и их субъединицы, а также определять их относительное количество. Кросс-линкинг масс-спектрометрия позволяет изучать взаимодействия между субъединицами.
- Различные биохимические методы: Эти методы включают в себя сайт-направленный мутагенез, химический кросслинкинг, гель-фильтрацию и другие.
Роль четвертичной структуры в заболеваниях
Нарушения в четвертичной структуре белков могут приводить к различным заболеваниям. Например:
- Серповидноклеточная анемия: Это генетическое заболевание, вызванное мутацией в гене бета-глобина, одной из субъединиц гемоглобина. Мутация приводит к тому, что гемоглобин полимеризуется в длинные волокна, деформируя эритроциты и приводя к нарушению кровотока.
- Болезнь Альцгеймера: При этом заболевании происходит агрегация белка бета-амилоида в головном мозге. Агрегаты бета-амилоида образуют бляшки, которые нарушают функцию нейронов.
- Прионные болезни: Прионные болезни, такие как болезнь Крейтцфельдта-Якоба, вызываются неправильно свернутыми белками, которые называются прионами. Прионы способны катализировать неправильное сворачивание других белков, приводя к образованию агрегатов и нейродегенерации.
Понимание роли четвертичной структуры в заболеваниях может помочь в разработке новых методов диагностики и лечения.
Будущее исследований четвертичной структуры
Исследования четвертичной структуры белков продолжают активно развиваться. Совершенствуются методы, позволяющие изучать структуру и динамику белковых комплексов с все более высоким разрешением. Особый интерес представляют исследования, направленные на:
- Понимание механизмов сборки и разборки белковых комплексов;
- Изучение влияния четвертичной структуры на активность и регуляцию белков.
- Разработку новых лекарств, нацеленных на белковые комплексы.
- Создание искусственных белковых комплексов с заданными свойствами.
Мы уверены, что в ближайшие годы нас ждет еще много интересных открытий в этой захватывающей области науки.
Сегодня мы совершили увлекательное путешествие в мир четвертичной структуры белков. Мы узнали, что это такое, как она формируется, какие функции выполняет и какую роль играет в заболеваниях. Надеемся, что эта статья помогла вам лучше понять эту важную область биохимии. Мы, как исследователи, всегда рады делиться своими знаниями и энтузиазмом с вами, нашими читателями. Спасибо за внимание!
Подробнее
| Белковая структура | Полипептидные цепи | Субъединицы белка | Гемоглобин структура | Четвертичная структура примеры |
|---|---|---|---|---|
| Агрегация белков | Взаимодействие белков | Рентгеноструктурный анализ | Криоэлектронная микроскопия | Функции белков |
Точка.