- Третичная структура белка: путеводитель для любопытных исследователей
- Что такое третичная структура белка?
- Силы, формирующие третичную структуру
- Домены в третичной структуре
- Методы исследования третичной структуры
- Вычислительные методы
- Значение третичной структуры для биологии и медицины
- Примеры влияния третичной структуры на функцию
- Третичная структура и разработка лекарств
Третичная структура белка: путеводитель для любопытных исследователей
Нам всегда было интересно, как же эти сложные молекулы, белки, складываются в такие уникальные формы, определяющие их функции. Ведь именно эта трехмерная структура, которую называют третичной, делает белок тем, чем он является – ферментом, антителом, структурным компонентом клетки. Представьте себе огромный конструктор LEGO, где каждая деталь имеет свое место, и только правильная сборка позволяет создать работающую модель. Белки работают по тому же принципу, и сегодня мы погрузимся в мир третичной структуры, чтобы разобраться, как это происходит;
В этой статье мы поделимся нашим опытом изучения третичной структуры белков, расскажем о силах, которые её формируют, методах исследования и о том, почему это так важно для понимания жизни на молекулярном уровне. Мы постараемся объяснить сложные вещи простым языком, чтобы даже новичок смог понять красоту и важность этой темы. Приготовьтесь к увлекательному путешествию в мир белковых молекул!
Что такое третичная структура белка?
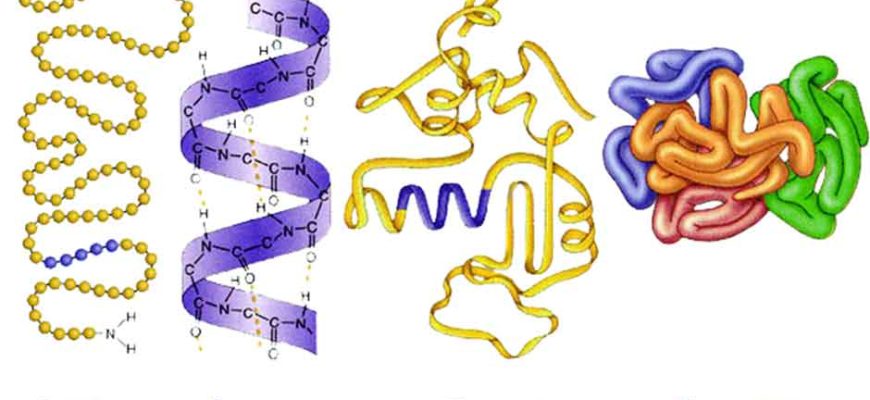
Когда мы говорим о третичной структуре белка, мы имеем в виду его полную трехмерную форму. Это не просто последовательность аминокислот (первичная структура) или локальные спирали и складки (вторичная структура). Это то, как вся полипептидная цепь сворачивается и изгибается в пространстве, образуя сложную структуру, которая определяет его биологическую активность. Представьте себе длинную цепочку бус, которая не просто висит прямо, а запутывается в клубок, образуя причудливый узор. Этот узор и есть третичная структура;
Третичная структура формируется благодаря взаимодействию различных аминокислотных остатков, расположенных далеко друг от друга в первичной структуре. Эти взаимодействия включают в себя водородные связи, ионные связи, дисульфидные мостики и гидрофобные взаимодействия. Все эти силы работают вместе, чтобы стабилизировать трехмерную форму белка и обеспечить его правильное функционирование. Без правильной третичной структуры белок не сможет выполнять свои задачи в клетке.
Силы, формирующие третичную структуру
Давайте рассмотрим более подробно силы, которые играют ключевую роль в формировании третичной структуры белка. Эти силы можно разделить на несколько основных типов:
- Водородные связи: Образуются между атомами водорода и электроотрицательными атомами, такими как кислород и азот.
- Ионные связи: Возникают между противоположно заряженными аминокислотными остатками.
- Дисульфидные мостики: Ковалентные связи, образующиеся между двумя остатками цистеина.
- Гидрофобные взаимодействия: Притягивают неполярные аминокислотные остатки друг к другу, выталкивая их из водной среды.
- Ван-дер-ваальсовы силы: Слабые взаимодействия, возникающие между всеми атомами.
Важно понимать, что все эти силы работают в совокупности, создавая сложный баланс, который определяет окончательную форму белка. Нарушение этого баланса может привести к денатурации белка, то есть потере его третичной структуры и, следовательно, его биологической активности.
Домены в третичной структуре
Часто третичная структура белка состоит из нескольких отдельных функциональных единиц, называемых доменами. Домен – это компактная, стабильная часть белка, которая может функционировать независимо от остальной части молекулы. Например, белок может иметь домен, связывающийся с ДНК, и домен, обладающий ферментативной активностью.
Домены часто встречаются в различных белках, что позволяет им выполнять сходные функции. Например, домен SH2, связывающийся с фосфорилированными тирозинами, встречается во многих белках, участвующих в передаче сигналов в клетке. Изучение доменов позволяет нам лучше понимать, как белки выполняют свои разнообразные функции.
Методы исследования третичной структуры
Изучение третичной структуры белков – сложная, но невероятно важная задача. К счастью, существует ряд мощных методов, которые позволяют нам "увидеть" трехмерную форму белка. Мы использовали некоторые из них в наших исследованиях, и можем поделиться своим опытом:
- Рентгеновская кристаллография: Один из самых распространенных методов. Белок кристаллизуют, а затем облучают рентгеновскими лучами. По дифракционной картине можно определить положение каждого атома в белке.
- Ядерный магнитный резонанс (ЯМР): Метод, позволяющий изучать структуру белков в растворе. ЯМР основан на взаимодействии ядер атомов с магнитным полем.
- Криоэлектронная микроскопия (крио-ЭМ): Белок замораживают в тонком слое льда, а затем облучают электронами. Крио-ЭМ позволяет изучать структуру крупных белковых комплексов с высоким разрешением.
Каждый из этих методов имеет свои преимущества и недостатки. Рентгеновская кристаллография требует получения хорошо упорядоченных кристаллов, что не всегда возможно. ЯМР подходит для изучения небольших белков. Крио-ЭМ позволяет изучать крупные комплексы, но требует сложного оборудования и обработки данных. Выбор метода зависит от конкретной задачи и свойств исследуемого белка.
Вычислительные методы
В дополнение к экспериментальным методам, существуют также вычислительные методы, которые используются для предсказания и моделирования третичной структуры белков. Эти методы основаны на знании первичной структуры белка и физико-химических свойств аминокислот.
Некоторые из наиболее распространенных вычислительных методов включают:
- Гомологичное моделирование: Основано на использовании известных структур белков-гомологов для предсказания структуры целевого белка.
- Ab initio моделирование: Пытается предсказать структуру белка с нуля, основываясь только на физических принципах.
- Молекулярная динамика: Имитирует движение атомов в белке, позволяя изучать его динамические свойства и конформационные изменения.
Вычислительные методы становятся все более мощными и точными, но они все еще не могут полностью заменить экспериментальные методы. Обычно используется комбинация экспериментальных и вычислительных подходов для получения наиболее полной информации о третичной структуре белка.
"Структура – это функция."
ー Френсис Крик
Значение третичной структуры для биологии и медицины
Понимание третичной структуры белков имеет огромное значение для различных областей биологии и медицины. Как мы уже говорили, именно третичная структура определяет функцию белка. Изменение третичной структуры может привести к потере активности белка или, наоборот, к приобретению новых, нежелательных свойств.
В медицине знание третичной структуры белков используется для разработки новых лекарств. Многие лекарства действуют, связываясь с белками и изменяя их активность. Зная структуру белка-мишени, можно разработать лекарство, которое будет связываться с ним наиболее эффективно и избирательно. Это позволяет создавать более эффективные и безопасные лекарства.
Примеры влияния третичной структуры на функцию
Вот несколько примеров того, как третичная структура белка влияет на его функцию:
- Ферменты: Третичная структура фермента определяет форму его активного центра, который связывается с субстратом и катализирует химическую реакцию.
- Антитела: Третичная структура антитела определяет форму его антигенсвязывающего сайта, который связывается с определенным антигеном.
- Рецепторы: Третичная структура рецептора определяет его способность связываться с определенным лигандом и передавать сигнал в клетку.
В каждом из этих случаев изменение третичной структуры белка может привести к нарушению его функции и, как следствие, к развитию болезни. Например, мутации в генах, кодирующих белки, могут приводить к изменению их третичной структуры и развитию наследственных заболеваний.
Третичная структура и разработка лекарств
Как уже упоминалось, знание третичной структуры белков играет ключевую роль в разработке новых лекарств. Этот процесс, называемый структурно-ориентированным дизайном лекарств, позволяет создавать лекарства, которые связываются с определенным белком-мишенью с высокой аффинностью и селективностью.
Процесс структурно-ориентированного дизайна лекарств обычно включает в себя следующие этапы:
- Определение третичной структуры белка-мишени.
- Моделирование взаимодействия различных молекул с белком-мишенью.
- Синтез и тестирование наиболее перспективных молекул;
- Оптимизация структуры лекарства для повышения его эффективности и безопасности.
Этот процесс требует использования сложных вычислительных методов и дорогостоящего оборудования, но он позволяет создавать более эффективные и безопасные лекарства, чем традиционные методы.
Мы надеемся, что эта статья помогла вам лучше понять, что такое третичная структура белка и почему она так важна. Это сложная, но невероятно интересная область науки, которая играет ключевую роль в понимании жизни на молекулярном уровне. Нам было очень интересно поделиться с вами нашим опытом изучения третичной структуры белков.
Продолжайте исследовать, задавайте вопросы и не бойтесь погружаться в сложные темы. Ведь именно так мы узнаем что-то новое и расширяем границы нашего понимания мира.
Подробнее
| Структура белка | Третичная структура | Формирование белка | Функция белка | Белковая молекула |
|---|---|---|---|---|
| Рентгеновская кристаллография | ЯМР спектроскопия | Криоэлектронная микроскопия | Денатурация белка | Домены белка |